
Муравьиное
аквапланирование: или "Шёл, поскользнулся, упал ... в кувшинчик Непентеса.

***
"Insectes sociaux", Муравьиные НОВОСТИ: Виды-2005 и 2004,
Статьи-2005 и 2004
 Термиты на кувшинчике Nepenthes (по: www.biozentrum.uni-
wuerzburg.de)
Термиты на кувшинчике Nepenthes (по: www.biozentrum.uni-
wuerzburg.de)
|
Добавлено 28-8-2005
|
|
Insect
aquaplaning: Nepenthes.
|
|
Bohn Holger F., Federle Walter.
Email:wfederle@biozentrum.uniwuerzburg.de
Zoologie II, Biozentrum, Am Hubland, 97074 Wurzburg, Germany.
Insect aquaplaning: Nepenthes pitcher plants capture prey with the peristome, a fully wettable water-lubricated anisotropic surface.
|
|

"Proc Natl Acad Sci U S A.", 2004,
Volume 101, Part 39, Pages 14138-14143 (Sep 2004)
|
|
|
Исследованы особенности кувшинообразных листьев растений рода Nepenthes помогающие им привлекать, заманивать и ловить насекомых. Список
цитированной литературы см.ниже. Сначала оригинальный реферат, а ниже мой перевод и дискуссия.
Pitcher plants of the genus Nepenthes have highly specialized leaves adapted to attract, capture, retain, and digest arthropod prey. Several
mechanisms have been proposed for the capture of insects, ranging from slippery epicuticular wax crystals to downward-pointing lunate cells
and alkaloid secretions that anesthetize insects. Here we report that perhaps the most important capture mechanism has thus far remained
overlooked. It is based on special surface properties of the pitcher rim (peristome) and insect "aquaplaning." The peristome is characterized
by a regular microstructure with radial ridges of smooth overlapping epidermal cells, which form a series of steps toward the pitcher inside.
This surface is completely wettable by nectar secreted at the inner margin of the peristome and by rain water, so that homogenous liquid films
cover the surface under humid weather conditions. Only when wet, the peristome surface is slippery for insects, so that most ant visitors
become trapped. By measuring friction forces of weaver ants (Oecophylla smaragdina) on the peristome surface of Nepenthes bicalcarata, we
demonstrate that the two factors preventing insect attachment to the peristome, i.e., water lubrication and anisotropic surface topography,
are effective against different attachment structures of the insect tarsus. Peristome water films disrupt attachment only for the soft
adhesive pads but not for the claws, whereas surface topography leads to anisotropic friction only for the claws but not for the adhesive
pads. Experiments on Nepenthes alata show that the trapping mechanism of the peristome is also essential in Nepenthes species with waxy inner
pitcher walls.
Смотрите об эволюции мирмекофитизма
обзор литературы по теме "муравьи-растения
Pheidole: отношения с растениями
2005: Cladomyrma тли и растения
Мирмекофиты: их подкармливают муравьи Pheidole?
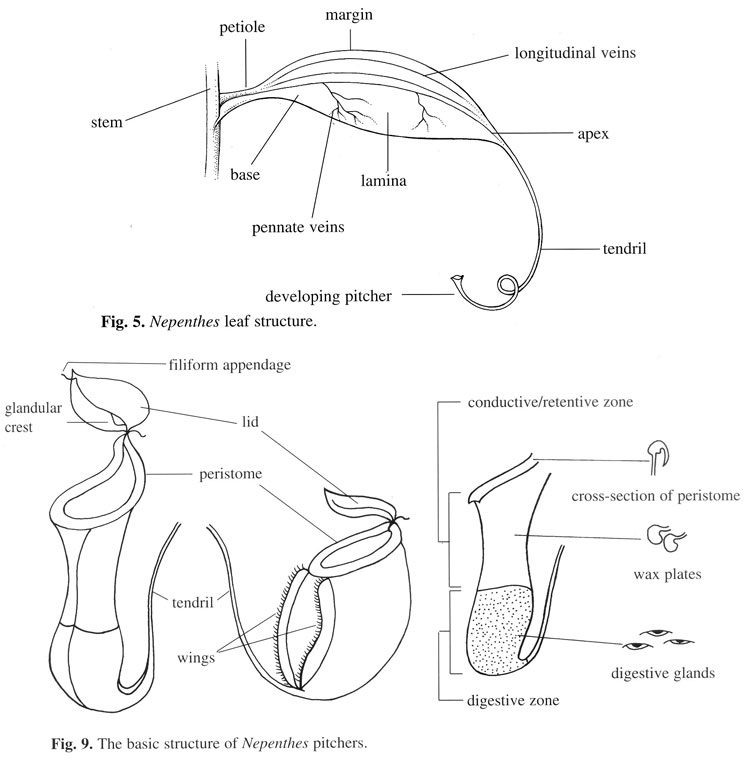
Строение кувшинчиков Nepenthes (Clarke 1997: Fig. 5, 9)
ВВЕДЕНИЕ
Растения с кувшинчиками из семейств Cephalotaceae (эндемичное семейство Цефалотовые из Австралийской
флористической области), Nepenthaceae (насекомоядные кустарники и лианы из Юго-Вост.Азии, от Китая и
Индии на севере и до Мадагаскара на западе, ок.70-100 видов и по 1 виду в Австралии, Новой Каледонии, на Шри-Ланке и Сейшеллах), и Sarraceniaceae (многолетние болотные травы, американское семейство насекомоядных двудольных растений, ок.20
видов) известны по своим заметным листьям, которые развились в кувшинчатые или трубчатые по форме органы, способные к поимке и перевариванию
членистоногих. Азот, полученный из перевариваемой добычи помогает этим растениям оставаться в живых в питательно - бедных условиях.
Функциональная морфология кувшинов и их механизма заманивания в ловушку давно и долго привлекает интерес биологов
(1-4). Было признано, что кувшины состоят из морфологически различных зон с отличающимися функциями (2, 5). Насекомые привлекаются внецветковым нектаром, ароматом цветка (6), или особенностями абсорбции UV-световых
лучей около входа кувшина (6, 7). При посещении кувшинов, насекомые могут падать внутрь него, и становятся
неспособными выбраться наружу из ловушки, и перевариваются ферментами жидкости кувшина и обитающей в нем infauna.
Многочисленные исследования функции кувшинов Nepenthes (род Кувшиночник) были сосредоточены на
механизме привлечения насекомых (6, 7), на заманивании в ловушку насекомых алкалоидной анестезией (8), скользкими эпикутикулярными кристаллами воска (3, 5, 9, 10) или идущими вниз лункообразными клетками (3) из внутренней стенке кувшина, на свойствах железистой зоны
(11), и на характере пищеварительной жидкости (12, 13, 14). Только
недавно, L. Gaume и другие (15) провели первое всестороннее изучение механизма заманивания в ловушку Nepenthes, сравнивая влияние различных зон поверхности кувшина и, отделяя механизмы захвата добычи и
задержания. Наблюдения насекомых, помещенных в кувшины Nepenthes alata предположили, что внутренняя восковая стена кувшина была наиболее
важной поверхностной зоной для начального захвата насекомых (15). Эти результаты подтверждали более ранние наблюдения, что
насекомые будут пойманы тогда, когда они ступают в восковую зону при посещении нектарников на внутренней стороне оправы кувшина (peristome)
(например, refs 2, 5, 7), [далее я для удобства использую
термин ПЕРИСТЕМА как гладкая ткань, хотя, возможно, более правильно говорить ПЕРИСТОМ, как орган "рот с губами" этого кувшинчика -
В.К.]. Восковая зона кувшинов Nepenthes характеризуется aldehyde кристаллами в форме пластинок
(platelet) выдающихся перпендикулярно от поверхности (9). Эти platelets не только отделяют и загрязняют поверхность липких
подушечек лапок насекомого, но также и видимо, взаимодействуют с липким секретом насекомого, чтобы формировать аморфное вещество, которое
препятствует прикреплению (10).
Однако, согласию относительно важности восковой зоны как главного механизма, заманивающего в ловушку кувшинчиков Nepenthes вредит факт, что у
нескольких видов Nepenthes (например, Nepenthes ampullaria, Nepenthes bicalcarata, и Nepenthes
ventricosa), восковая зона отсутствует. В кувшинчиках N. ampullaria были найдены накопленные
некромассы, главным образом, растительного происхождения и этот вид растений может, таким образом, рассматриваться скорее детритоядным (detritivorous), чем насекомоядным (insectivorous) (16, 17). Однако, данные относительно спектра добычи и эффективности захвата N. bicalcarata ясно показывают,
что кувшины этого вида - полностью функциональные ловушки насекомых, несмотря на отсутствие в них восковой зоны (18, 19). Подобно многим другим видам рода Nepenthes, N. bicalcarata захватывает прежде
всего муравьев (18, 20). Каков механизм захвата у этого и других видов, где никакие скользкие
поверхностные кристаллы воска не обнаружены?
МАТЕРИАЛ И МЕТОДИКА
Field Work
Наблюдения и полевые эксперименты на N. bicalcarata проводились в различных участках в деградирующих лесах с доминированием Shorea albida и с
торфяными болотами в Брунее, северо-запад острова Борнео. Авторы исследовали механизм заманивания в ловушку N. bicalcarata, наблюдая
поведение муравьев на поверхности кувшина. Испытания проводились, используя пять видов муравьев различных размеров, принадлежащих к
естественному спектру добычи N. bicalcarata на выбранном участке изучения [сухие веса этих муравьев: Crematogaster inflata, 0.66 ± 0.12 mg; Camponotus (Colobopsis)
sp., 2.4 ± 1.1 mg; Camponotus sp., 2.9 ± 1.8 mg; Polyrhachis hector, 18.4 ± 6.5 mg; и Polyrhachis cf.
Beccarii, 21.0 ± 8.2 mg; означает ± SD n = 20 рабочих на каждый вид]. Чтобы привести большие количества муравьев в
контакт с кувшинчиками N. bicalcarata, авторы собрали частичные колонии (50-300 рабочих) и содержали их в пластмассовых контейнерах, боковые
стенки которых покрывали скользким слоем Fluon (Whitford, Diez), предотвращая разбегание муравьев. Кувшины N. Bicalcarata были помещены
вертикально на подставке внутри пластмассового контейнера так, чтобы муравьи имели в него доступ.
Была сделана запись поведения муравьев в течение 5-10 минуты, используя видеокамеру [Sony (Токио) DCR-PC120E]. Чтобы корректировать
подсчет изменяющегося числа фуражирующих муравьев, была измерена эффективность заманивания в ловушку как отношение числа пойманных муравьев к
общему количеству "посещений перистемы" (муравьи со всеми ногами вступившими в контакт с перистемой, прохождение линии центра перистемы было
оценено как её посещение). В первом наборе экспериментов, авторы сравнили эффективность заманивания в ловушку кувшинов с естественной (сухой)
и увлажненной перистемой с перечисленными выше 5 видами муравьев. Более обширный экспериментальный протокол был выполнен с муравьем-ткачем
Oecophylla smaragdina. Авторы сделали запись поведения муравьев на кувшине (i) с сухой
перистемой , (ii) после увлажнения перистемы, используя пульверизатор atomizer, (iii) после осушения с помощью свободной от пыли
тканью, и (iv) после повторного увлажнения.
Во втором эксперименте, авторы исследовали, способны ли муравьи, которые упали в кувшины N. bicalcarata убежать из него и какие части кувшина
являются ответственными за их задержание. Муравьям позволяли идти на полосах пластиковой пленки, покрытой на кончике с Fluon. Мягко
поворачивая полосу, когда муравей шел на скользкой части, муравьев роняли в кувшины с высоты перистемы. Всего 282 муравья (30-60 муравьев
каждой разновидности) были протестированы и наблюдалась по 30 мин.
Morphology
Свежие кувшинчики растений были взяты из оранжереи и заморожены в жидком азоте и высушены в lyophilizer при температуре –40°C, с напылением
platinum–palladium на 5 минут при силе тока в 25 mA, и наблдались в электронном сканирующем микроскопе Zeiss DSM 962 (с рабочим напряжением
5–15 kV). Для получения SEM-изображений контакта муравьиных лапок с перистемой авторы анестезировали муравьев O. smaragdina и приклеивали их
с помощью воска к перистеме N. bicalcarata. Пробы на живых муравьях были сделаны без напыления при рабочем напряжении в 3 kV.
Friction of O. smaragdina Ants on the Peristome of N. bicalcarata
... ... ...
Effect of Peristome in Nepenthes Species with Waxy Inner Pitcher Walls
... ... ...
РЕЗУЛЬТАТЫ
... ... ...
Morphology
... ... ...
Trapping Function of the Pitcher Peristome in N. bicalcarata
... ... ...
Retention of Insect Prey
... ... ...
Friction of O. smaragdina Ants on the Peristome of N. bicalcarata
... ... ...
Effect of Peristome in Nepenthes Species with Waxy Inner Pitcher Walls
... ... ...
ДИСКУССИЯ
Иследования этих авторов показало, что кувшины Nepenthes bicalcarata захватывают насекомых с помощью
их скользкой перистемы (peristome). Обнаружено, что когда влажно, поверхность перистемы чрезвычайно скользкая, так, что большинство насекомых,
ступающих на перистему падают внутрь кувшина и становятся добычей, принимая во внимание, что фактически никакие насекомые не были захвачены,
когда перистема сухая.
Несмотря на довольно долгий столетний и пристальный интерес ученых к кувшинам растений рода Nepenthes, о механизмах заманивания в эту ловушку и об эффективной функции перистемы в процессе заманивания в
ловушку, - к настоящему времени осталась мало что известно. Основываясь на морфологической структуре и предполагаемой функции, Хукер (Hooker, 22) разделил внутреннюю часть кувшина на "привлекательную" зону (attractive zone), которая включила крышку и перистему,
"скользкую" зону (conductive, восковая часть внутренней стены) и "пищеварительную зону" (digestive, самая нижняя внутренняя часть кувшина).
Более поздние авторы также не полагали, что перистема была непосредственно вовлечен в механизм заманивания в ловушку. Ллойд (Lloyd, 2) заметил, что поверхность перистемы - " ... не скользкая (...), поскольку как наблюдалось, что маленькие насекомые
(муравьи, и т.д.) могут идти свободно по ней, используя свои ноги. " Juniper и Burras (23) отметили, что " ... муравьи,
кажется, способны идти относительно свободно по перистеме, " и что "перистема отдельно не кажется серьезным препятствием для спасения всех
типов насекомых." Moran и другие (7) отметили, что "... перистема, кажется, предлагает безопасную точку опоры для
большинства посещающих её беспозвоночных. " Только Juniper и Burras (23) выдвинули гипотезу, что перистема может быть
"сомнительной точкой опоры" для некоторых насекомых из-за своей гладкости. Однако, гладкость поверхности отдельно не есть проблема для
насекомых, оборудованных тарзальными липкими подушечками лапок. Многие насекомые способны справиться с силами отделения > 100 раз большими их
собственного веса тела) на совершенно гладких субстратах (24, 25).
Механизм скользкости (slipperiness) перистемы основан на присутствии смазочной воды или нектарного слоя и на микроструктурированной
поверхности перистемы. Поверхность перистемы содержит микроскопические впадины между соседними эпидермалными клетками, которые могут быть в
соответствующем диапазоне того размера, чтобы обеспечить закрепление для коготков насекомых (26), но только в направлении к
внешней стороне кувшина. Кроме коготков, многие насекомые обладают липкими подушечками на кончиках лапок, которые используются на гладких
поверхностях, где когти терпят неудачу в качестве органа прикрепления. Анализ сил трения муравья-ткача O.
smaragdina на перистеме удивительно точно показал, что анизотропия поверхности почти не имеет никакого влияния на силы трения
липких подушечек лапок (The analysis of friction forces of O. smaragdina ants on the peristome surprisingly
revealed that surface anisotropy has hardly any effect on friction forces of the adhesive pads.). Однако, когда только использовались или
имелись только коготки, силы трения были меньшие во внутренней части кувшина, но большие ближе к внешней стороне, что как видим зависит от
топографии поверхности. Напротив, присутствие водных слоев на перистеме не имело никакогог влияния на силы, удерживающие коготки, но
совершенно не нарушало прикрепление липких подушечек лапок. Авторы предполагают, что сользкость влажной перистемы вызвана
aquaplaning, то есть, смазочным влиянием воды или нектарного слоя (тонкой пленки) между липкими подушечками лапок и
поверхностью перистемы. На гладкой поверхности, липкие подушечки лапок насекомых могут производить большие силы трения если их мягкая кутикула
или входит в очень близкий контакт или непосредственно взаимодействуют с субстратом (27). Если поверхность закрыта
жидкостью, липкие подушечки могут вступать в такой контакт, только выдавливая жидкость, которая может замедлять процесс в зависимости от
вязкости жидкости. Стабильность очень тонкого жидкого слоя размещенного между мягкими липкими лапками и поверхностью зависит от тенденции слоя
к увлажнению (dewet) и устанавлением сухих липких контактов (28). Увлажняющий эффект (Dewetting) определен с помощью
коэффициента S:
S = DSA - (DSL + DLA),
где DSA, DSL, и DLA - solid/adherend, solid/liquid и liquid/adherend межповерхностные силы натяжения
(давления, interfacial tensions), соответственно. Смазка увеличена, если S положителен (жидкий слой устойчивый) или отрицательный и маленький
[замедляют dewetting (29)], оба из которых уменьшаются, если субстрат - хорошо увлажнен wettable (то есть у него маленький
DSL).
Имеются несколько возможных механизмов того, как перистема Nepenthes становится влажной при
естественных условиях: (i) дождь, (ii) конденсация влаги и (iii) секреция нектара. Даже при том, что крышка кувшина может
предотвращать его полное затопление у некоторых видов Nepenthes, это обычно полностью не ограждает
перистему от дождя. Перистема N. bicalcarata была действительно влажной и скользкой для насекомых после ливней. Из-за сильной почти 100-
процентной влажности воздуха в тропических джунглях, поверхность перистемы может также покрываться росой. Наконец, нектар секретируемый
большими перистемальными нектарниками может формировать жидкие пленки (в статье имеется соответствующий рис. 1B). Местоположение этих
нектарников между зубце-подобными выступами во внутреннем крае peristome (рис. 1C) идеален для распространения нектара на peristome
поверхность. Однако, поскоьку объем выделяемого нектара и время его выделения не был определен количественно, вклад этого нектара в степень
скользкости перистемы все еще остается неясным. Присутствие нектара (вместо чистой воды) на перистемовой поверхности, будучи привлекательным
для насекомых, может иметь значение для увеличения скользкости перистемы. Во-первых, сахар, остающийся на поверхности после испарения нектара
может быть гигроскопичным и мог бы облегчать сгущение. Во вторых, нектар более вязкий, чем чистая вода из-за высокого сахарного содержания (33), который может делать перистему даже более скользкий.
Механизм скользкости перистемы кувшинчиков Nepenthes имеет замечательные экологические последствия.
Независимо от детального механизма увлажнения перистемы, можно предсказать, что имеется сильное временное изменение эффективности процесса
заманивания в кувшинообразную ловушку. У большинства видов Nepenthes, включая N. bicalcarata,
муравьи доминируют в спектре добычи (7, 20). Гипотетически более вероятно, что, вообще более низкие нормы
захвата муравьев являются выгодными, потому что остающиеся в живых бойскауты (муравьи-фуражиры и разведчики) могут мобилизовать и привести ещё
большее количество соплеменников к нектарным ресурсам кувшина Непентесов (20, 34). Результаты показывают,
что эффективность захвата муравьев кувшинчиками Nepenthes временно повышается из-за присутствия водных пленок на перистеме, но низка, когда
она суха. Как последствие, мобилизация муравьев к кувшинчику с нектаром будет работать эффективно, в то время когда перистема сухая, но
большие группы завербованных муравьев, могут стать пойманными в ловушку, когда перистема скользкая. Скользкость перистемы не только изменяется
по времени, но и может также быть непредсказуема для прибывающих муравьев. Временное разделение вербовки муравьев и захвата добычи могло бы
представлять стратегию для поимки муравьев, которая выше по уровню простого заманивания в ловушку. Авторы предсказывают, что эффективность
заманивания в ловушку кувшинчика изменится согласно дневным и погодным условиям. Секреция нектара и обусловленное температурой уплотнение
может показывать дневные максимумы охотничьей эффективности. Увлажнение перистемы дождем может кончаться более высокими нормами захвата в
течение дождливых сезонов, которые могут совпадать с периодами увеличенного роста и большего требования питательных веществ.
Полученные авторами результаты демонстрируют, что механизм заманивания в ловушку перистемы не ограничен одним видом Nepenthes bicalcarata, но также важен и в другом виде рода Nepenthes с восковыми внутренними стенами кувшина
типа N. alata. Только, когда перистема была сухой, тогда восковая поверхность N. alata наиболее важной зоной для заманивания в ловушку, что согласуется с предыдущими наблюдениями
(возможно сделанными на сухой перистеме; см. ссылки 2, 5, и 15). Однако, когда перистема
была влажной, большинство муравьев скользило в кувшин от перистемы, часто даже без касания восковой поверхности. Наиболее важно, увлажненная
перистема увеличивает в 3 раза нормы захвата. Таким образом, даже при том, что перистема бывает влажной только временно, вклад в полную норму
захвата добычи мог бы быть значителен. Функциональное значение восковой зоны могло бы состоять больше в задержании насекомых, которое,
кажется, менее эффективным в свободном от воска кувшинчиках N. bicalcarata (см. рис. 2B в статье и сылку 15). Необходимы
дальнейшие исследования, чтобы уточнить относительную важность различных механизмов заманивания в ловушку (восковые стенки или перистема?) в
полевых условиях.
Вид N. Bicalcarata - исключительный член рода Nepenthes из-за его мирмекофитической ассоциации с муравьем
Camponotus schmitzi Starke (35). Специализированные гнезда муравьев находятся в раздутых полых усиках
кувшинчиков их растения-хозяина. Кроме сбора сладкого урожая из внецветковых нектарников, муравьи Camponotus
schmitzi питаются большими остатками (кусками) добычи, захваченными их растением-хозяином, который они вытаскивают из жидкости
кувшина и транспортируют в свой муравейник (19). В большом контрасте к другим видам, такой древесный муравей как Camponotus schmitzi способен не только к плаванию и прыжкам в пищеварительной
жидкости хищного кувшина, но также и может бегать по влажной и скользкой перистеме; они никогда не становятся пойманными в этих кувшинах.
Авторы сообщают в заключении, что они в настоящее время исследуют механизмы этих очаровательных адаптаций.
БЛАГОДАРНОСТИ
Как и положено в научных статьях, в самом конце приводятся благодарности всем помогавшим в этой работе: David Marshall (Universiti Brunei
Darussalam), Marlis and Dennis Merbach, Ulrich Maschwitz (J. W. Goethe University, Frankfurt am Main), and Reinhard Jetter (University of
British Columbia, Vancouver) за помощь в полевых исследованиях и в плодотворных дискуссиях. Авторы также обязаны помощи оказанной немецкими
Ботаническими садами (Botanical Garden, Wurzburg и садом Пальм Palmengarten, Frankfurt am Main). Разрешение на полевые работы получены с
помощью The Universiti Brunei Darussalam, the Brunei Museum, и Department of Forestry of Brunei. Это иследование было материально поддержано
грантом от Deutsche Forschungsgemeinschaft (SFB 567/C6 and Emmy–Noether fellowship FE 547/1–2 to W.F.).
***
|
| |
|
©2005, Vladislav Krasilnikov (translation & supplement)
|
|
Всякое использование без согласования с автором и без активной гиперссылки на наш сайт
преследуется в соответствии с Российским законодательством об охране авторских прав.
|
Здесь приведен список литературы из обсуждаемой статьи.
Поиск в базе Formis-2003 по другим словам из этой темы (растения и муравьи) дает
такие результаты: ant-epiphytes (4), ant-plant (279), ant-garden (14), domatia (68), elaiosome (66), extrafloral nectaries (211), food bodies
(51), fungus (724), mutualism (393), myrmecophile (1896), myrmecophyte (273), myrmechory (4), pollination (122), seeds (255). Смотрите
список литературы по теме "растения и муравьи" на отдельной
страничке.
- Darwin, C. (1875) Insectivorous Plants (Appleton, London).
- Lloyd, F. E. (1942) The Carnivorous Plants (Ronald Press, New York).
- Knoll, F. (1914) Jahrb. Wiss. Bot. 54, 448–497.
- Adams, R. M. & Smith, G. W. (1977) Am. J. Bot. 64, 265–272.
- Juniper, B. E., Robins, R. J. & Joel, D. M. (1989) The Carnivorous Plants (Academic, London).
- Moran, J. A. (1996) J. Ecol. 84, 515–525.
- Moran, J. A., Booth, W. E. & Charles, J. K. (1999) Ann. Bot. 83, 521–528.
- Ratsirarson, J. & Silander, J. A. (1996) Biotropica 28, 218–227.
- Riedel, M., Eichner, A. & Jetter, R. (2003) Planta 218, 87–97.
- Gaume, L., Perret, P., Gorb, E., Gorb, S., Labat, J.-J. & Rowe, N. (2004) Arthropod. Struct. Dev. 33, 103–111.
- Gorb, E. V. (2004) Comp. Biochem. Physiol. A 137, S82–S83.
- Hepburn, J. S. (1918) Proc. Am. Philos. Soc. 57, 112–129.
- Amagase, S. (1972) J. Biochem. 72, 765–767.
- Tokes, Z. A. (1974) Planta 119, 39–46.
- Gaume, L., Gorb, S. & Rowe, N. (2002) New Phytol. 156, 479–489.
- Cresswell, J. E. (1998) Oecologia 113, 383–390.
- Moran, J. A., Clarke, C. M. & Hawkins, B. J. (2003) Int. J. Plant Sci. 164, 635–639.
- Merbach, M. A., Zizka, G., Fiala, B., Maschwitz, U. & Booth, W. E. (2001) Flora 196, 153–160.
- Clarke, C. M. & Kitching, R. L. (1995) J. Trop. Ecol. 11, 589–602.
- Clarke, C. & Wong, K. M. (1997) Nepenthes of Borneo (Natural History Publications, Kota Kinabalu, Malaysia).
- Owen, T. P. & Lennon, K. A. (1999) Am. J. Bot. 86, 1382–1390.
- Hooker, J. D. (1859) Trans. Linn. Soc. 22, 415–424.
- Juniper, B. E. & Burras, J. K. (1962) New Sci. 13, 75–77.
- Eisner, T. & Aneshansley, D. J. (2000) Proc. Natl. Acad. Sci. USA 97, 6568–6573.
- Federle, W., Rohrseitz, K. & Holldobler, B. (2000) J. Exp. Biol. 203, 505–512.
- Dai, Z., Gorb, S. N. & Schwarz, U. (2002) J. Exp. Biol. 205, 2479–2488.
- Federle, W., Baumgartner, W. & Holldobler, B. (2004) J. Exp. Biol. 207, 67–74.
- Martin, A., Buguin, A. & Brochard-Wyart, F. (2001) Langmuir 17, 6553–6559.
- Martin, P. & Brochard-Wyart, F. (1998) Phys. Rev. Lett. 80, 3296–3299.
- Juniper, B. E. & Jeffree, C. E. (1983) Plant Surfaces (Edward Arnold, London).
- Holloway, P. J. (1969) J. Sci. Food Agric. 20, 124–128.
- Bico, J., Thiele, U. & Quere, D. (2002) Colloids Surfaces A 206, 41–46.
- Wolf, A. V., Brown, M. G. & Prentiss, P. G. (1984) in CRC Handbook of Chemistry and Physics, ed. Weast, R. C. (CRC,
Boca Raton, FL), pp. D223–D272.
- Joel, D. M. (1988) Biol. J. Linn. Soc. 35, 185–197.
- Schuitemaker, J. P. & Staercke, A. (1933) Overdr. Natuurhist. Maandbl. 22, 29–31.
|
| |
|



