|
Проведен обзор структурной организации и распределения 20 различных экзокринных желез на ногах муравьев, в том числе 4 типа обнаружены впервые у муравьев.
Кроме их очевидной локомоторной функции и следовательно присутствию мускульных волокон, ноги муравьев также обеспечены удивительным разнообразием экзокринных желез.
В данной работе дается обзор структурного разнообразия всех известных на сегодня 20 различных типов желез, обнаруженных на всех трех парах ного муравьев, четыре типа желез обнаружены здесь впервые. Железы располагаются на различных сегментах ног от наиболее проксимальных (coxa) до наиболее дистальных сегментов ног (pretarsus). Значительная часть желез, особенно из расположенных на задней паре ног, связаны своей функцией с продукцией следовых феромонов. Среди прочих обнаруженных функций: чистка антенн, продукция смазывающих веществ (lubricant substances) и половых феромонов.
KEY WORDS: Morphology; Ultrastructure; Exocrine glands; Legs
Первые экзокринные железы на ногах у муравьев были обнаружены в 1968, когда у Crematogaster нашли тибиальные железы (Leuthold, 1968). И почти четверть века она оставалась единственной ножной железой вплоть до начала интенсивных исследований и открытий в 1990-х гг.
МЕТОДИКА
This comprised fixation of leg parts in 2% cold glutaraldehyde
(buffered at pH 7.3 with 50 mM Na-cacodylate and 150 mM saccharose)
and post-fixation in 2% cold osmium tetroxide in the same
buffer. Tissues were dehydrated through a graded acetone series
and embedded in araldite. Semi-thin sections with a thickness of
1 mm for light microscopy were stained with methylene blue and
thionin, thin sections at 70 nm for electron microscopy were double
stained with lead citrate and uranyl acetate, and examined in a Zeiss
EM900 electron microscope. Legs prepared for scanning electron
microscopy were critical point dried in a Balzers CPD 030 instrument
and examined in a Philips XL30 ESEM scanning microscope.
Оглавление статьи
1. Introduction
2. Survey of the exocrine glands in the legs of ants
2.1. Basicoxal gland
2.2. Coxal gland
2.3. Trochanter gland
2.4. Apicofemoral gland
2.5. Distal femoral gland
2.6. Distal femoral sac gland
2.7. Proximal tibial gland
2.8. Tibial tendon gland
2.9. Metatibial gland
2.10. Apicotibial gland
2.11. Distal tibial glands
2.12. Tibial spur gland
2.13. Antenna cleaner gland
2.14. Basitarsal gland
2.15. Proximal tarsomere glands
2.16. Tarsomere glands
2.17. Third tarsomere gland
2.18. Distal tarsomere glands
2.19. Footprint gland
2.20. Arolium gland
2.1. Basicoxal gland
Рабочии и матки некоторых понероморфных муравьев имеют эпителиальную базикоксальную железу на проксимальной части кокс на их средних и задних ногах (Billen and Ito, 2006). Эта железа находится на внешней дорзальной части коксы и представляет из себя thickened differentiation тегументального эпидермиса (Fig. 3A). Its position and ultrastructural characteristics are indicative for a lubricant function
for the ball-and-socket junction of these legs with the thorax:
apical microvilli and transcuticular pores facilitate transportation of
the secretory products, while the presence of smooth endoplasmic
reticulum is in agreement with an oily composition of the secretion
(Fig. 3B). The gland is absent in the forelegs, however, which can be
understood by the different articulation of the rather immobile fore
coxae, compared to the higher manoeuvrability of the coxae of
the mid- and hindlegs (Billen and Ito, 2006). Автор не обнаружил литературных данных о наличии сходных желез у других насекомых.
2.2. Coxal gland
Этот класс желез (Class-3 glandular cells) был обнаружен на внутренней части кокс всех трех пар ног рабочих муравьев Pachycondyla obscuricornis и нескольких других видов, на проксимальной части около сочленения с тораксом, и на дистальной части около сочленения с бедром (Schoeters and Billen, 1993; Fig. 3A). Так же как и у базикоксальной железы, их клетки содержат многочисленные свободные рибосомы, но в них нет гранулярного эндоплазматического ретикулума. The accompanying duct cells open through the
corresponding intersegmental articulation membranes (Fig. 3C),
where the secretion is thought to serve a lubricant function for the
heavily sclerotized species in which they occur (Schoeters and
Billen, 1993). Сходные bicellular gland clusters были найдены позднее на проксимальной части кокс у безжальных пчел (Cruz Landim et al., 1998), а также обнаружены на коксах термитов вида Prorhinotermes termites (Šobotnik et al., 2003).
2.3. Trochanter gland
Проксимальная вентральная часть вертлуга несет очевидный железистый эпителий (Fig. 3A,D), который очень соден с в его клеточной организации с базикоксальными железами. Они найдены на трех парах ног и обнаружены у видов, принадлежащих к разным филогенетически удаленным родам, таким как Atta, Camponotus, Oecophylla, Diacamma, Leptogenys, Odontomachus, Odontoponera, Probolomyrmex и Proceratium
(Billen, 2008). Its common occurrence, in both queens
and workers, and its position at the site where maximal movement
occurs against the distal part of the coxa again supports a lubricant
function. While there is no report on glandular structures in
the trochanter of termites (Soares and Costa-Leonardo, 2002),
glands in the distal part of the trochanter have been described in
stingless bees, although these correspond to the bicellular unit type
(Cruz Landim et al., 1998; Cruz-Landim, 2002), and therefore are not
homologous with the trochanter gland in ants.
ИЛЛЮСТРАЦИИ
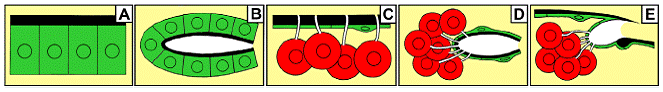
Fig. 1. Схематическое изображение 5 главных типов желез насекомых. (A) Epithelial glands without reservoir. (B) Epithelial glands with reservoir. (C) Bicellular unit glands without reservoir. (D) Bicellular unit glands with reservoir. (E) Bicellular gland units opening through articulation membrane. Все типы желез, кроме типа D, представлены на ногах у муравьев (see also Table 1).
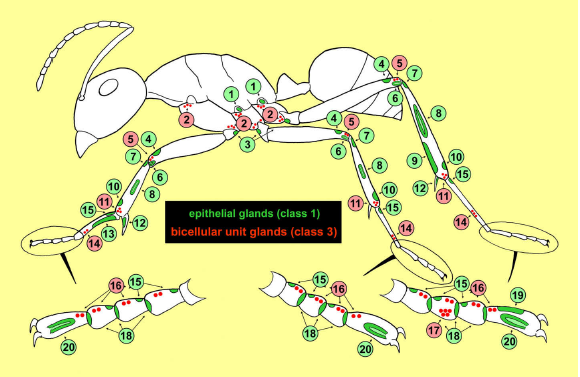
Fig. 2. Схематический профиль муравья, показывающий ранообразие экзокринных желез на ногах, с указанием типа желез. Table 1.
1 Basicoxal gland.
2 Coxal gland.
3 Trochanter gland.
4 Apicofemoral gland.
5 Distal femoral gland.
6 Distal femoral sac gland.
7 Proximal tibial gland.
8 Tibial tendon gland.
9 Metatibial gland.
10 Apicotibial gland.
11 Distal tibial gland.
12 Tibial spur gland.
13 Antenna cleaner gland.
14 Basitarsal gland.
15 Proximal tarsomere glands.
16 Tarsomere glands.
17 Third tarsomere gland.
18 Distal tarsomere glands.
19 Footprint gland.
20 Arolium gland.
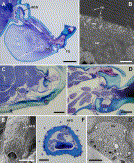
Fig. 3. (A) Midleg coxa and trochanter of Odontoponera transversa, illustrating position of basicoxal gland (BCG), coxal gland cells (CG) and trochanter gland (TG); scale bar 200 µm. (B) Electron micrograph of apical region of hindleg basicoxal gland epithelium of Centromyrmex feae with microvilli (mv), smooth endoplasmic reticulum (ser) and cuticular pores (cp); scale bar 1 µm. (C) Distal part of hindleg coxa of Diacamma vagans with coxal gland cells (CG); scale bar 50 µm. (D) Midleg coxa-trochanter junction of Diacamma sp., showing trochanter gland (TG); scale bar 50 µm. (E) Foreleg femur of Pyramica benten, AFG indicates differently sculptured cuticle overlaying apicofemoral gland; scale bar 50 µm. (F) Cross section through distal region of hindleg femur of Strumigenys sydorata, showing apicofemoral gland (AFG); scale bar 20 µm. (G) Electron micrograph of midleg apicofemoral gland of Strumigenys sp. 586, showing apical microvilli (mv) and secretory vesicles (sv); scale bar 5 µm.
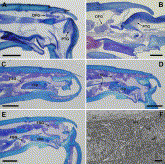
Fig. 4. (A) Hindleg femur–tibia junction in Diacamma vagans, showing cell cluster of distal femoral gland (DFG). PTG, proximal tibial gland; scale bar 100 µm. (B) Femur–tibia junction in midleg of Harpegnathos saltator. DFG, distal femoral gland; PTG, proximal tibial gland; scale bar 50 µm. (C–E) Parallel sections through femur–tibia junction in hindleg of H. saltator at different levels, showing epithelium of distal femoral sac gland (FSG), which is separated in an upper and lower part by the robust cuticular base plate (cbp); scale bar 100 µm. (F) Electron micrograph of distal femoral sac gland in hindleg of H. saltator, showing apical microvilli (mv) and endocuticle (ct); scale bar 1 µm.
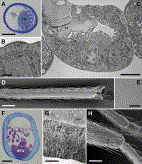
Fig. 5. (A) Cross section through hindleg tibia of Crematogaster scutellaris with large tibial tendon gland (TG); scale bar 50 µm. (B) Apical region of tibial tendon gland epithelium and lining cuticle of C. scutellaris, showing microvilli (mv) and cuticular pores (cp); scale bar 1 µm. (C) Cross section through tibial tendon gland in midleg of Formica polyctena, illustrating how cuticular lining of gland epithelium (ct) is continuous with tibial tendon (TT); scale bar 5 µm. (D) Scanning electron micrograph of the distal ventral hindleg tibia of Eciton burchellii, showing smooth cuticle overlaying the metatibial gland; scale bar 200 µm. (E) Detail of D, revealing presence of numerous small pores; scale bar 10 µm. (F) Cross section through hindleg tibia of Cylindromyrmex whymperi. Note epithelial cells of metatibial gland (MTG), and striated cuticular lining due to presence of minute cuticular pores; scale bar 50 µm. (G) Detail of apical cytoplasm and cuticle of hindleg metatibial gland of Dorylus molestus, showing microvilli (mv) and cuticular pores (cp); scale bar 5 µm. (H) Hindleg tibia of male of Pyramica benten, arrow indicates apicotibial gland region; scale bar 50 µm.
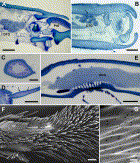
Fig. 6. (A) Junction between hindleg tibia and basitarsus of Dorylus molestus, showing cluster of distal tibial gland cells (DTG). Arrow indicates corresponding duct cells opening through articulation membrane with basitarsus (from Billen, 1997, with permission from R. Belg. Soc. Zool.). PtG = proximal tarsomere gland in basitarsus; scale bar 50 µm. (B) Distal part of foreleg tibia of D. molestus with cluster of distal tibial gland cells (DTG) and ducts opening through outer cuticle (arrow); scale bar 50 µm. (C) Cross section through tibial spur of Amblyopone reclinata hindleg, showing epithelial cells of tibial spur gland; scale bar 20 µm. (D) Longitudinal section of hindleg tibial spur of Odontoponera transversa queen with thickened epithelium of tibial spur gland (arrows); scale bar 100 µm. (E) Longitudinal section through proximal part of foreleg basitarsus of Cataglyphis niger, depicting large antenna cleaner gland (ACG); scale bar 50 µm. (F) Scanning electron micrograph of proximal part of basitarsal antenna cleaning apparatus on foreleg of Dinoponera quadriceps, showing basitarsal cleaning brush (cb) and smooth area covering antenna cleaner gland region (ACG); scale bar 100 µm. (G) Detail of smooth area of E, revealing presence of numerous small cuticular pores; scale bar 1 µm.
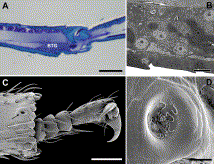
Fig. 7. (A) Longitudinal section through distal region of hindleg basitarsus of Onychomyrmex sp., showing basitarsal gland cluster (BTG); scale bar 50 µm. (B) Electron micrograph of hindleg basitarsal gland cells of Prionopelta kraepelini (from Ito and Billen, 1998, with permission from R. Belg. Soc. Zool.); scale bar 5 µm. (C) Distal part of midleg of Melissotarsus beccarii, arrow indicates opening of basitarsal gland; scale bar 50 µm. (D) Detail of basitarsal gland opening in midleg of M. weissi, showing toothpaste-like secretion oozing out from cuticular pores; scale bar 5 µm.
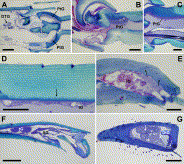
Fig. 8. (A) Longitudinal section through midleg tibia-basitarsus junction of Dorylus molestus, showing cluster of distal tibial gland cells (DTG) and epithelium of proximal tarsomere gland (PtG); scale bar 50 µm. (B) Longitudinal section through junction between tarsomeres t1 and t2 in hindleg of Atta sexdens rubropilosa queen with proximal tarsomere gland (PtG); scale bar 50 µm. (C) Longitudinal section through junction between tarsomeres t1 and t2 in foreleg of Dinoponera quadriceps with proximal tarsomere gland (PtG); scale bar 50 µm. (D) Dorsal tegument of tarsomere t2 of D. quadriceps, showing tarsomere glands (tG), arrow indicates ducts; scale bar 50 µm. (E) Tarsomere t2 in hindleg of A. sexdens rubropilosa queen, showing tarsomere gland secretory cells (tG) and ducts (arrows); scale bar 50 µm. (F) Longitudinal section through hindleg pretarsus of Eciton burchellii, showing cluster of tarsomere gland cells (tG) and epithelial arolium gland (AG); scale bar 100 µm. (G) Longitudinal section through hindleg tarsomere t3 of Nothomyrmecia macrops, filled with secretory cells of third tarsomere gland. Arrows indicate ducts. DtG = distal tarsomere gland epithelium. Note opening of third tarsomere gland ducts through anterior ventral region, in contrast to tarsomere glands that open through dorsal tegumental cuticle. Scale bar 50 µm.
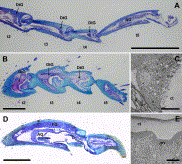
Fig. 9. (A) Longitudinal section through midleg tarsomeres t2–5 of Myrmecia pyriformis, showing arolium gland (AG) in pretarsus and repeated occurrence of distal tarsomere gland epithelium (DtG); scale bar 500 µm. (B) Longitudinal section through tarsomeres t2–5 in foreleg of Atta sexdens rubropilosa queen with repeated occurrence of distal tarsomere gland (DtG); scale bar 200 µm. (C) Electron micrograph of distal tarsomere gland epithelium of hindleg 3rd tarsomere of Nothomyrmecia macrops (from Billen et al., 2000b, with permission from Aust. J. Zool./CSIRO Publishing), ct = cuticle, mv = microvilli; scale bar 5 ?m. (D) Longitudinal section through hindleg pretarsus of Amblyopone reclinata (from Billen et al., 2005, with permission from Arthropod Structure and Development/Elsevier), showing arolium gland (AG) and footprint gland (FG); scale bar 100 µm. (E) Electron micrograph of apical region of arolium gland epithelium in hindleg pretarsus of Myrmecia forficata, ct = cuticle, mv = microvilli; scale bar 5 µm.
***
|











